| Page précédente |
2.2.2
Notion d’affinité et d’entropie
Le chemin est encore long entre ces atomes isolés et l’organisme vivant que
nous sommes, mais nous en avons déjà parcouru un long depuis les quarks
originels indifférenciés et ces éléments épars dans l’espace, ou
rassemblés dans la masse des planètes nouvellement formées. On a longtemps
cru que le passage de l’atome à la molécule complexe était une suite de
processus entièrement régie par le hasard, et de ce fait, le produit des
probabilités d’occurrence de ces événements étant proche de zéro, que l’apparition
de la vie était un événement exceptionnel, hautement improbable, et unique.
Ces convictions ont été fortement ébranlées par l’expérience de Stanley
Miller en 1953 qui, mélangeant les composants atmosphériques de la terre
primitive, à savoir principalement du méthane et du gaz carbonique dans un
ballon de verre, y reproduisant les conditions de température et de pression
et simulant les éclairs des orages par des étincelles électriques eut la
surprise de voir apparaître dans le ballon des composés complexes,
résultats de réactions chimiques entre les éléments simples primordiaux.
Dans certaines conditions donc, les atomes et molécules simples ont tendance
à se lier et à se combiner pour
produire des composés complexes dont on ignorait jusqu’alors les modes de
formation. La découverte fut que ces conditions d’apparition de ces
composés n’avaient rien d’exceptionnel, et que donc ces réaction avaient
du se produire en maint endroit de l’univers, voire du système solaire. La
chimie apparaissait donc comme « orientée » vers la vie.
Il est à noter que depuis cette expérience, des molécules
relativement complexes et appartenant au domaine de la chimie organique, donc
potentiellement pré biotiques, ont été observées non pas sur des
planètes, mais dans l’espace intersidéral.
Les comètes, boules de glace d’eau sale, traversant cet espace se
chargent en ces molécules et les déposent à la surface des planètes en s’y
écrasant. On pense ainsi que les molécules briques de la vie, et l’eau,
milieu privilégié de son développement, ont été amenés sur terre par ces
comètes. Dès lors, l’apparition de la vie n’a plus rien d’unique, c’est
son développement qui requiert des conditions exceptionnelles.
L’entropie d’un système est souvent assimilé à son désordre.
Ainsi, il est commun de dire que l’entropie du système que constitue l’univers
augmente, car son désordre augmente. En fait, l’entropie est plus une
mesure de l’information que l’on peut obtenir d’un système, étant
donné qu’il est plus facile de mesurer et d’étudier un système ordonné
que sans structure. Dans son ensemble, l’univers a tendance à s’étendre
indéfiniment, et au cours du temps de brûler tous ses constituants
originaux, principalement l’hydrogène et l’hélium au sein des étoiles
comme il a été expliqué au paragraphe précédent. On peut donc imaginer à
terme, dans plusieurs dizaines de milliards d‘années, un univers froid et
sombre dans lequel erreraient des astres de fer, élément qui serait devenu,
au terme des nucléosynthèses, le plus abondant. Dans ce contexte, la chimie
puis la vie s’opposent à cette évolution, en formant les composés
organiques complexes, qui de part la définition qui en a été donnée,
réduisent localement l’entropie des systèmes plus ou moins isolés que
constituent les biotopes. Ces affinités et cette propension des éléments
simples à former des composés toujours plus complexes dépassent de loin les
cadres exclusifs de la chimie et de la physique et seront abordés de nouveau
en fin d’exposé dans le cadre plus général des aspects philosophiques.
2.3
De la molécule simple à la molécule prébiotique
3
2.3.1
Rappel de chimie du carbone. Liaisons
tétravalentes
4
2.3.1.1
Rappel
sur les valences
Sans trop approfondir le domaine ardu de la liaison chimique, il est
important d’en connaître quelques notions afin de comprendre les
mécanismes d’agencement des atomes entre eux et la genèse des
molécules, en l’occurrence organiques, qui en découle. Cette explication
se limite aux deux premières lignes du tableau périodique des éléments
de Mendéleiev.
Quelques règles simples gèrent ces processus. On a vu que le nombre de
protons du noyau déterminait la nature de l’élément ( et ses
propriétés physiques). Autour du noyau gravitent des électrons, en nombre
égal au nombre de protons du noyau. Ces électrons déterminent les
propriétés chimiques de l’élément. Loin de se positionner au hasard
autour du noyau, ces électrons obéissent à des règles strictes.
La « tendance » des atomes est d’avoir leurs couches d’électrons
complètes.
La première couche est complète à deux électrons, la seconde à huit
(règle de l’octet).
A l’exception des gaz rares (pour les deux premières lignes du tableau de
Mendeleïev, hélium et Néon, en rouge), les atomes n’ont pas de couche
extérieure complète.
Ainsi, pour ces deux premières lignes, appelant « 1 » la première
couche et « 2 » la seconde, on aura pour les différents
éléments l’architecture suivante (le chiffre indiquant le nombre d’électrons) :
| ELEMENT | H | He | Li | Be | B | C | N | O | F | Ne |
| N° Atom. | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| Couche 1 | 1 | 2 | 2 | 2 | 2 | 2 | 2 | 2 | 2 | 2 |
| Couche 2 | 0 | 0 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
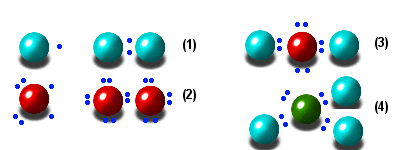 l'hydrogène
(figure 1), chaque électron est mis en commun. La couche extérieure de
chaque atome (qui est la première, donc complète à deux) est remplie. Il
en va de même pour l'oxygène (figure 2) avec la seconde couche qui
se complète à huit électrons par la mise en commun de deux électrons par
atome. On ne rencontrera donc pratiquement jamais les atomes H et O isolés,
mais les molécules H2 et O2.
l'hydrogène
(figure 1), chaque électron est mis en commun. La couche extérieure de
chaque atome (qui est la première, donc complète à deux) est remplie. Il
en va de même pour l'oxygène (figure 2) avec la seconde couche qui
se complète à huit électrons par la mise en commun de deux électrons par
atome. On ne rencontrera donc pratiquement jamais les atomes H et O isolés,
mais les molécules H2 et O2.
La même logique est respectée dans la molécule d'eau H2O
(figure 3) où deux hydrogène mettent en commun chacun un électron avec
l'oxygène central, ou dans celle d'ammoniac (figure 4) ou l'atome d'azote
central a besoin de trois électrons : NH3
Le
nombre d'électrons libres dans un atome, susceptibles de ce lier, est
appelé "valence".
Un électron et l'atome sera dit monovalent.
Deux électrons et l'atome sera dit bivalent.
Trois électrons et l'atome sera dit trivalent.
Quatre électrons et l'atome sera dit tétravalent.
Au delà de quatre électrons libres, l'atome en les mettant en commun
libère la couche inférieure complète. Tout se passe comme s'il les
perdait. Des atomes à 5, 6 et 7 électrons périphérique seront donc
respectivement tri, bi et monovalents.
2.3.1.2 Simple,
double et triple liaison
Selon
ce principe, l’atome de carbone est tétravalent. Il est donc capable de
se lier à 4 atomes monovalents - exemple 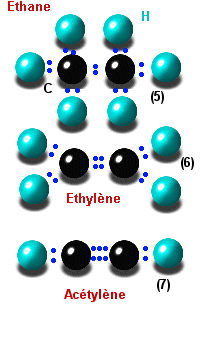 avec
l’hydrogène, C + 4H = CH4, c’est le méthane (en fait, C +
2H2=CH4)-, à deux atomes bivalents - exemple avec l’oxygène,
C + 2O = CO2, le gaz carbonique (C + O2 = CO2)
. Toutes les combinaisons sont possibles (avec l’azote, trivalent, le
carbone tétra et l’hydrogène mono, on a H-CºN
: acide cyanhydrique, poison violent mais composé prébiotique
incontournable). Il peut aussi se lier à lui même selon des liaisons
simples, laissant alors la possibilité de se lier à 3 valences par atome,
soit 6 en tout. Il peut aussi se lier à lui même en double liaison
(laissant 4 radicaux libres) ou en triples liaisons (laissant 2 radicaux
libres). Remplaçons ces radicaux libres par des atomes d’hydrogène
monovalent, on aura alors H3C-CH3 (éthane, figure 5)
pour la simple liaison, H2C=CH2 (éthylène, figure6)
pour la liaison double et HCºCH
(acétylène, figure 7) pour la triple. En continuant ce raisonnement, les
atomes de carbone peuvent se lier entre eux selon de véritables chaînes
(H3C-CH2-CH2-CH3 : butane) ou encore (H2C=C=CH2 : propène) etc. On ne
représente alors que le squelette carboné et les atomes autres que l’hydrogène
dans ce squelette .
avec
l’hydrogène, C + 4H = CH4, c’est le méthane (en fait, C +
2H2=CH4)-, à deux atomes bivalents - exemple avec l’oxygène,
C + 2O = CO2, le gaz carbonique (C + O2 = CO2)
. Toutes les combinaisons sont possibles (avec l’azote, trivalent, le
carbone tétra et l’hydrogène mono, on a H-CºN
: acide cyanhydrique, poison violent mais composé prébiotique
incontournable). Il peut aussi se lier à lui même selon des liaisons
simples, laissant alors la possibilité de se lier à 3 valences par atome,
soit 6 en tout. Il peut aussi se lier à lui même en double liaison
(laissant 4 radicaux libres) ou en triples liaisons (laissant 2 radicaux
libres). Remplaçons ces radicaux libres par des atomes d’hydrogène
monovalent, on aura alors H3C-CH3 (éthane, figure 5)
pour la simple liaison, H2C=CH2 (éthylène, figure6)
pour la liaison double et HCºCH
(acétylène, figure 7) pour la triple. En continuant ce raisonnement, les
atomes de carbone peuvent se lier entre eux selon de véritables chaînes
(H3C-CH2-CH2-CH3 : butane) ou encore (H2C=C=CH2 : propène) etc. On ne
représente alors que le squelette carboné et les atomes autres que l’hydrogène
dans ce squelette .
Cette propriété du carbone de former des chaînes et ainsi une
multitude de composants a permis, dans la grande variété des molécules
formées, l’apparition de ces molécules prébiotiques, toutes basées sur
cette architecture. On les a regroupées en trois familles distinctes : les
glucides, les lipides et les protides.
NB
: Sortant du cadre de cet exposé, on peut cependant noter de multiples
exceptions à cette règle générale. Ainsi, la molécule d’oxyde de
carbone (CO), les composés nitreux et nitriques, les composés du soufre,
et toutes les molécules mettant en jeu les couches au delà de la seconde,
dont les valences peuvent varier, car influencées par les couches
inférieures. Il ne faut retenir de ces explications que la stabilité et l’immense
variété des composés à base de squelette carboné, qui forment ce que l’on
appelle la chimie organique.
2.3.1.3 Rappel
glucides, lipides, protides
Les
Glucides.
Communément appelé « sucres », les glucides sont en général
composé d’une molécule cyclique de 4 ou 5 atomes de carbone entre
lesquels s’intercale un atome d’oxygène. Ils se caractérisent
principalement par des groupements hydroxy (-OH) périphériques qui leur
assurent une très bonne solubilité dans l’eau, de part les liaisons
hydrogène qu’ils forment avec les ions H+ et OH-. Cette famille est très
variée; on y trouve :
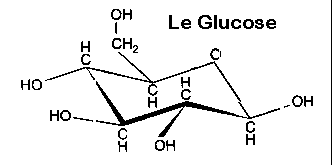 -
Les monosaccharides. Composés d’une
seule chaîne cyclique. Il s’agit du glucose, le plus connu, mais aussi du
galactose (cycles à 6 atomes dont 5C et un O), et du fructose. Il est
à noter que beaucoup de sucres ont une formule brute identique (ex glucose
et galactose C6H12O6), et ne diffèrent que
de part la position des atomes dans la molécule.
-
Les monosaccharides. Composés d’une
seule chaîne cyclique. Il s’agit du glucose, le plus connu, mais aussi du
galactose (cycles à 6 atomes dont 5C et un O), et du fructose. Il est
à noter que beaucoup de sucres ont une formule brute identique (ex glucose
et galactose C6H12O6), et ne diffèrent que
de part la position des atomes dans la molécule.
- Les disaccharides
sont formés de l’assemblage, par liaison entre deux radicaux hydroxy avec
élimination d’eau, de deux monosaccharides. Le plus connu est le
saccharose (sucre de canne, réunion d’une molécule de glucose avec une
molécule de fructose), mais aussi le lactose, sucre contenu dans le lait.
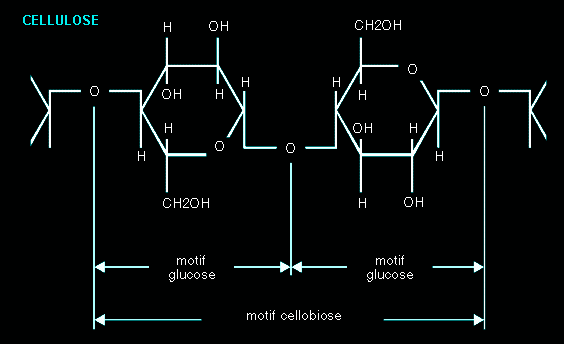
- Les polysaccharides.
Ils résultent de la réunion de plusieurs monosaccharides en longues
chaînes. Le plus connu des polysaccharides est l’amidon, longue chaîne
de molécules de glucose, à haut poids moléculaire. Le nombre de
« monomères » n’est pas défini pour des chaînes de cette
taille (C6H10O5)n; Une chaîne d’amidon
de brisant restera de l’amidon, car les propriétés du corps varieront
peu. Ce n’est qu’après une véritable digestion (par la salive par
exemple, qui contient l’amylase salivaire, enzyme qui brise les liaisons
entre les molécules de glucose) que l’amidon sera totalement réduit en
glucose. Le glycogène, réserve d’énergie de l’organisme stocké dans
le foie, est également un polysaccharide, de même que la cellulose,
omniprésente dans les végétaux.
- Le ribose,
monosaccharide cyclique, est à la base des acides nucléiques constituants
de l’ARN, et, en perdant un radical OH (désoxy), de l’ADN.- En se
combinant aux protides et aux lipides, les glucides forment les
glycoprotéines et les glycolipides.
Il est à noter enfin que, contrairement aux protéines dont la formule est
déterminée génétiquement et une fois pour toutes lors de leur synthèse
à partir des gènes, la structure des glucides et de leurs combinaisons
dépendent en partie du milieu et peut varier en fonction de l’environnement
Cette capacité à se modifier leur permet d’acquérir de l’information
et de jouer de ce fait un rôle important dans le système immunitaire.
Les Lipides
Ce sont les graisses. Les briques de ces molécules sont les
acides gras, constitués
principalement de longues chaînes carbonées, terminées par un groupement
acide (-COOH) et ne comportent pas de radicaux -OH. De ce fait, ils sont
insolubles dans l’eau. Selon qu’une double liaison s’intercale entre
deux carbones de la chaîne ou non, on les qualifiera d’insaturés ou de
saturés.
Exemple, l'acide oleïque : CH3-CH2-CH2-CH2-CH2-CH2-CH2-CH2-CH=CH-CH2-CH2-CH2-CH2-CH2-CH2-CH2-COOH
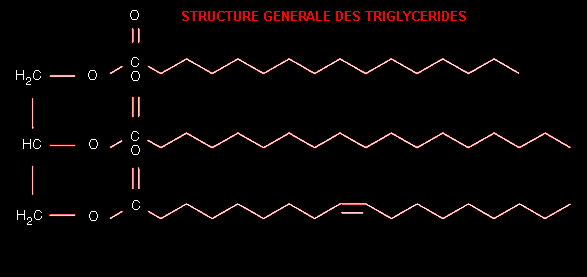 On
rencontre ces graisses principalement sous la forme de triglycérides.
Ce sont des molécules issues du glycérol, qui est un sucre, dans lequel
les trois radicaux -OH se sont liés avec le radical acide des acides gras
avec élimination d’eau. Les triglycérides constituent la plupart des
graisses animales et végétales.
On
rencontre ces graisses principalement sous la forme de triglycérides.
Ce sont des molécules issues du glycérol, qui est un sucre, dans lequel
les trois radicaux -OH se sont liés avec le radical acide des acides gras
avec élimination d’eau. Les triglycérides constituent la plupart des
graisses animales et végétales.
Les
phospholipides, dans lesquels un
des groupements OH du glycérol a réagi avec de l’acide phosphorique. De
ce fait, ces molécules comportent une partie chargée électriquement et
susceptible de se lier avec l’eau, donc hydrophile, et une partie
constituée d’acides gras, hydrophobe. Les phospholipides constituent les
membranes cellulaires, assemblés en double couche, parties hydrophobes
tournées vers l’intérieur.

Certains
lipides enfin ne sont pas constitués d’acides gras. C’est le cas du cholestérol,
d’ou dérive une grande quantité de substances essentielles, telles que
les hormones stéroïdiennes, la cortisone, la vitamine D. Le carotène,
provitamine A, participe à la vision nocturne en tant que pigment des
cellules en bâtonnets de l’oeil.
Schéma d'une membrane où l'on distingue, intercalés entre les phospholipides, les protéines (traversant de part en part la membrane) et les sucres, vecteurs de l'identité de la cellule.
Les
Protides
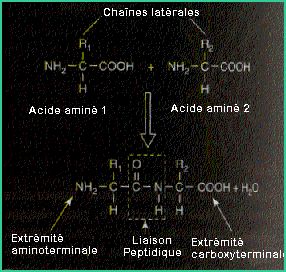 Les
protides ou protéines sont formées d’un assemblage d’acides aminés.
Les acides aminés ont tous comme propriété commune de posséder un
radical -COOH acide et un radical -NH2 amine fixés sur le même atome de
carbone. A cet atome est lié un radical, qui peut être très différent d’un
acide aminé à l’autre, et qui lui confère ses propriétés
particulières. Les acides aminés se lient entre eux selon des liaisons
dites « peptidiques » très fortes, et s’assemblent ainsi en
molécules pouvant devenir extrêmement complexes. La variété du radical
-R est sans limite, mais seuls 20 combinaisons se retrouvent dans les
protéines. Ces sont les 20 acides aminés essentiels.
Les
protides ou protéines sont formées d’un assemblage d’acides aminés.
Les acides aminés ont tous comme propriété commune de posséder un
radical -COOH acide et un radical -NH2 amine fixés sur le même atome de
carbone. A cet atome est lié un radical, qui peut être très différent d’un
acide aminé à l’autre, et qui lui confère ses propriétés
particulières. Les acides aminés se lient entre eux selon des liaisons
dites « peptidiques » très fortes, et s’assemblent ainsi en
molécules pouvant devenir extrêmement complexes. La variété du radical
-R est sans limite, mais seuls 20 combinaisons se retrouvent dans les
protéines. Ces sont les 20 acides aminés essentiels.
Ces briques s’assemblent donc en molécules plus lourdes, appelées
peptides pour celles issues de la réunion d’un petit nombre d’acides
aminés, et polypeptides ou protéines pour les plus importantes.
 Les
protéines jouent un rôle d’une part par les types de liaisons et d’atomes
qui les composent (structure primaire), en réagissant chimiquement, et d’autre
part de par leurs formes très complexes (structures secondaires et
tertiaires) qui peuvent activer ou au contraire perturber certaines autres
réactions en tant qu’enzymes ou inhibiteurs.
Les
protéines jouent un rôle d’une part par les types de liaisons et d’atomes
qui les composent (structure primaire), en réagissant chimiquement, et d’autre
part de par leurs formes très complexes (structures secondaires et
tertiaires) qui peuvent activer ou au contraire perturber certaines autres
réactions en tant qu’enzymes ou inhibiteurs.
Les protéines sont présentes partout dans l’organisme. Pour ne citer que
les plus connues, l’hémoglobine
transporte l’oxygène et le gaz carbonique du sang par le biais de
réactions d’oxydoréduction des atomes de fer ferreux ou ferriques
contenus en son sein. La myoglobine constitue le muscle et en assure la
mobilité. La membrane cellulaire, constituée comme il a été vu de
phospholipides, serait imperméable sans les protéines intercalées qui
jouent un rôle de porte entre les milieux intra et extra cellulaires.